
Efectos
de
microorganismos
eficientes
(EM)
en
el enraizamiento
y
desarrollo
vegetativo
de
cladodios
de
pitahay
(Hylocereus
undatus)
Effects
of
efficient
microorganisms
(EM)
on
rooting
and
vegetative
development
of
pitahaya
(Hylocereus
undatuss)
cladodescladodescladodess
Elvis
Michael
Carrera
Abanto
0000-0001-5492-7096
Universidad
Científica
Del
Surr
18000902@cientifica.edu.pe
CitaCita
en
APA:
Carrera,
E.
M.
(2023).
Efectos
de
microorganismos
eficientes
(EM)
en
el
enraizamiento
y desarrollo
vegetativo de cladodios de pitahaya (Hylocereus
undatus).
Revista Latinoamericana
de
Ciencias
Agrarias,
1(2), 3-18.
Resumen
La principal
forma de propagar la
pitahaya (Hylocereus
undatus) es
de manera vegetativa por lo
que es importante la calidad del
material utilizado, ya que de ello depende
el resto del proceso
productivo. En los
objetivos se
consideró determinar los
efectos de tres dosis
de (EM) en el enraizamiento y desarrollo vegetativo de
cladodios de pitahaya (Hylocereus undatus).
Las evaluaciones
se realizaron
en unidades
experimentales
homogéneas, con
48 cladodios de
pitahaya de
30 cm,
los factores
de estudio
fueron los
EM en
dosis de
25 ml/L,
50 ml/L y 75 ml/L. Los resultados evidenciaron que la aplicación de
EM influyó significativamente
en laa
longitudd dee
brote,, pesoo
frescoo y
pesoo secoo
dee brote,,
asíí comoo
enn la longitudd
dee raíz,,
pesoo frescoo
y pesoo
secoo dee
raíz,, lograndoo
incrementarr suss
valoress conn
la aplicación de 75 ml/L de EM (T3)..
Palabras claves:
Microorganismos
eficientes, enraizamiento, desarrollo vegetativo, pitahaya
Abstract
The
main
way
to
propagate
pitahaya
(Hylocereus
undatus)
is
vegetatively,
so
the
quality
of
the material used
is important, as the rest of the production process depends on it.
The objective
of
this
research
was
to
determine
the
effects
of
efficient
microorganisms
(EM)
on rooting and
vegetative development of pitahaya (Hylocereus undatus)
cladodes. The evaluations were carried out in homogeneous
experimental units, with 48 pitahaya cladodes of 30 cm, the study
factors were the EM in doses of 25 ml/L, 50 ml/L and 75 ml/L. The
results showed that the
application of MS
had a significant influence on
shoot length, fresh
weight and
shoot dry
weight, as
well as
on root
length, fresh
weight and
root dry weight,
increasing their
values with
the application of
75 ml/L
of MS
(T3).
Keywords:
Efficient
microorganisms,
rooting,
vegetative
development,
pitahaya
Introducción
La pitahaya es una especie perenne, hemiepífita de carácter
trepadora con tallos de forma triangular y acostillados; por lo que
requiere de un adecuado sistema de tutorado. Esta
especie pertenece al orden
Caryophyllales, familia
de las cactáceas, género Hylocereus
(Kishore, 2016)
y es
originaria de
América Tropical,
principalmente de
América Central
y el Caribe,
y tiene
la capacidad
de adaptarse
a diversas
condiciones ambientales,
razón por el
cual está siendo
sembrada ampliamente y
es apreciada a nivel comercial en países asiáticos como
China, Vietnam, Indonesia y Corea (Verona et al., 2020), y en países
de América Latina como
Colombia, Brasil,
Venezuela, México,
Ecuador y
Costa Rica
los cuales
son a su
vez los
principales países
productores y
exportadores de
pitahaya (Enciso
et al.,
2011).
Asimismo,
la
pitahaya
roja
(Hylocereus
undatus)
es
una
especie
que
posee
flores
grandes de
aproximadamente 29 cm de longitud, de coloración verdosa o
amarillenta, e interiormente
cuenta con
segmentos de
perianto de
color blanco.
El fruto
de la
pitahaya es por lo
general de color rojizo y de pulpa blanca, cubierto por bracteolos de
color rojo y verde en
las puntas.
El tamaño
promedio del
fruto es de
11.3 cm
a 14.2
cm, mientras
que la circunferencia promedio del fruto es de 25.5 cm a 29.1
cm (Warusavitharana et al., 2017).
Además, presenta
tallos triangulares,
de ángulo
convexo entre
las yemas
del tallo.
La
demanda
de
la
pitahaya
a
nivel
internacional
ha
generado
gran
interés
en
el
territorio nacional,
por lo que
se han
incrementado las áreas
de cultivo de pitahaya
principalmente en la
región de
Piura,
Lambayeque,
Ica
y San Martín.
Las
variedades
de
pitahaya
roja
tienen mejor
adaptabilidad al clima costero del Perú, mientras que las variedades
de pitahaya amarilla
se
adaptan
mejor
a
climas
amazónicos.
Es
por
ello
que
la pitahaya
amarilla
es
más cultivada
en la
selva peruana,
principalmente en
la región
San Martín,
donde se
cultiva la especie
H.
megalantus
(Vargas
&
López,
2020).
Respecto a
la mejora
del cultivo
de pitahaya,
hay investigaciones
que enfatizan
que la propagación
de estacas debe pasar por un proceso de enraizamiento previamente al
sembrado con
la finalidad
de que
los brotes
y raíces
se desarrollen
uniformemente, puesto
que la
siembra directa
de las
estacas tiene
una tasa
muy baja
de desarrollo
y enraizamiento
(Garbanzo et
al., 2021).
Los injertos
son otra
alternativa para
la propagación
asexual, para lo
cual
es
esencial
un
material
vegetal
de
calidad
con
características
genéticas
óptimas
para ser
injertadas
en
otras
variedades
(Costa
et
al.,
2006).
También
se
puede
realizar
cultivos
in vitro, de esta
manera se asegura que se obtengan plantas saludables y libres de
enfermedades.
Además,
este
procedimiento
es
usado
para
mejorar
genéticamente
cualquier especie
(Cuellar et al., 2006; Montesinos et
al., 2015).
Los
mayores
avances
sobre
los
EM
iniciaron
con
las
investigaciones
del
profesor
Teruo Higa en
Okinawa (1970), quien siempre tuvo el interés por la búsqueda de
nuevas alternativas naturales
en la
agricultura, y
tras varios
experimentos reunió
y seleccionó
80 especies de microorganismos con efectos positivos en el
desarrollo vegetativo y la productividad de los cultivos (Morocho &
Leiva, 2019). Entre los microorganismos fotosintéticos
que forman
parte de
los EM
se encuentra
el Rhodopseudomonas
palustris y
Rhodobacter sphaeroides (Hoyos et al., 2008). Además, los EM
contienen bacterias rizosféricas que promueven
laa producciónn
dee auxinass
y citoquininas,,
ambass fitohormonass
importantes paraa ell
desarrolloo vegetativoo
y radicularr
dee lass
plantass (Zafarr
ett al.,,
2012)..
Con respecto
a la
eficiencia de
los EM,
existen diversos
estudios que
documentan sus
beneficios; por ejemplo, en el cultivo de tomate tras la aplicación
de microorganismos eficientes,
los resultados
de biomasa
y rendimiento
fueron mejores
en comparación
con el grupo
de
control,
obteniendo
20%
más
en
el
rendimiento
(Alarcon
et
al.,
2020).
Asimismo, en el
cultivo de frijol se determinó que los microorganismos eficientes
influyen significativamente en los parámetros morfológicos y
productivos, incrementando la producción de hojas en 92%, la altura
de planta en 72% y el rendimiento del cultivo en 153% (Calero et al.,
2019).
El objetivo general del presente estudio es conocer qué
microorganismos son más beneficiosos para el crecimiento y
desarrollo de los cladodios de pitahaya (Hylocereus undatus).
Como otro objetivo se
consideró, determinar la
dosis adecuada que
permita un mejor
desarrollo
vegetativo
pitahaya
(Hylocereus
undatus).
Método
Este trabajo
de investigación
se llevó
a cabo
en el
vivero de
pitahayas Perú,
el cual
se encuentra ubicado en el distrito de Ancón del departamento
de Lima (11°44'09.7"S 77°08'45.5"W) a 80 m s. n. m. El
lugar de estudio presenta un clima cálido, con una temperatura
promedio de 26.2 °C en verano, y de 14.3 °C en invierno, con una
precipitación media anual de 12.7 mm, de acuerdo a la data
meteorológica del Servicio Nacional
de Meteorología
e Hidrología
del Perú
(SENAMHI).
La
investigación
fue
del
tipo
experimental,
adaptado
de
Alarcon
et
al.
(2020).
Consistió en un
diseño completamente
al azar
(DCA), con
cuatro tratamientos
y doce
repeticiones. Asimismo,
fase experimental
tuvo una
duración de
cuatro meses,
desde marzo
hasta julio del
2022. El análisis de las variables y la recolección de los datos
fueron realizados al segundo mes (día 60) y cuarto mes (día 120)
del experimento. Para cada evaluación, se analizó
6 plantas
por tratamiento.
Para el
análisis del
enraizamiento se
realizó la
medición del
tamaño,
peso
fresco
y
peso
seco
de
las
raíces;
y
para
el
desarrollo
vegetativo,
se
evaluó
el tamaño,
peso fresco
y peso
seco de
los brotes.
Para determinar
el peso
fresco se
utilizó una
balanza electrónica, y para la determinación del peso seco, los
brotes y raíces fueron colocadas en una
estufa por 24 h a
115 °C, y
posteriormente fueron pesadas.
El desarrollo de la fase experimental consistió en una recolección
de 48 estacas de pitahaya de
30 cm
de plantas
madre de
6 años
de la
especie H.
undatus del
fundo San
José ubicada en la
ciudad de Huaral,
Lima. El corte de
las estacas se
realizó en punta
hacia la parte de
la base
y se
dejó que
el corte
cicatrice por
7 días
para evitar
que se
infecten. Para
facilitar el enraizamiento se realizó el despunte del esqueje y
posteriormente fueron colocadas en bolsas de vivero de 2.5 L con su
respectivo sustrato. Toda la etapa experimental
se desarrolló
en condiciones
de vivero
con 50%
de luz
directa para
lo cual
se utilizó un
techoo dee
mallaa raschel..
Ell riegoo
dee lass
plantass see
realizóó 2
vecess a
laa semana,,
4 litros por riego.
El EM
utilizado fue
el producto
comercial EM*1®,
el cual,
según sus
especificaciones técnicas,
contiene
bacterias
fotosintéticas
(≥
1.6
x
104
UFC/ml),
bacterias
ácido-lácticas
(≥ 4.3
x 103
UFC/ml), levaduras
(≥ 3.3
x 104
UFC/ml) y
enzimas. Para
elaborar el
activado inicial de EM, en un recipiente herméticamente
cerrado se diluyó 5% del producto comercial y 5% de melaza en 90%
de agua. Se dejó reposar la mezcla durante 3 a 6 días hasta
que emita
un olor
agridulce y
un pH
de 3.5.
Posteriormente, para
la aplicación
en los
tratamientos se
diluyó en
agua en
las proporciones
especificadas en
la en
la siguiente
tabla (ver Tabla
1). La aplicación
fue directo al
sustrato cada
10 días durante los dos
primeros meses.
Tabla 1
Tratamiento
y
dosis
utilizados
en
la
investigación
-
-
-
Tratamientos
|
Dosis
ml/L
|
Compuesto
|
T0
|
0.0
|
Agua
|
T1
|
25
|
EM
|
T2
|
50
|
EM
|
T3
|
75
|
EM
|
Nota:
Testigo
absoluto
(T0), tratamientos
(T1,
T2yT3).
Fuente:
Elaboración
Propia.
La aplicación
de EM
genera efectos
positivos en
la nutrición
y adquisición
del agua. Estimula
el desarrollo de las raíces incrementando el tamaño radical debido
a que los nutrientes se encuentran más disponibles para la planta.
Los EM están compuestos por grupos microbianos tales como los
microorganismos que producen ácido láctico, las bacterias que
producen luz, los parásitos, los hongos, los actinomicetos y los
gusanos filamentosos son
todos ejemplos
de fermentación
(Morocho &
Leiva, 2019).
Algunos de estos
microorganismos
tienen
la
capacidad
de
solubilizar
nutrientes
tales
como
P
y
K,
y
de fijar
el N2
atmosférico
convirtiéndolos en
formas asimilables
para la
planta.
Los
resultados
fueron
analizados
mediante
el
programa
estadístico
SPSS
versión
20.1. Asimismo, se
realizó el
análisis de
varianza (ANOVA)
con las variables
de desarrollo
vegetativo y desarrollo
radicular. Además, se realizó la
prueba
de
comparación de
medias a través
de la prueba
de Tukey.
Los análisis
se realizaron
con un
nivel de
significancia de
0.05.
Resultados
Los resultados obtenidos se describen a continuación en orden a las
variables analizadas.
Características físicas, químicas y de contenido de nutrientes del
suelo. En el análisisinicial del
sustrato
realizado
en
el
mes
de
marzo
del
2022
(ver
Tabla
2),
se
evidencia
que
el
suelo utilizado
para el
experimento es
arenoso, con
contenido medio
de materia
orgánica,muy ligeramente
salino
y
con
ligera
acidez.
No
hubo
cambios
en
la
clase
estructural
del
sustrato. La
disponibilidad de nutrientes: fósforo, nitrógeno y potasio, es
media. Mientrasque al cuarto mes se evidenció algunos cambios, el pH pasó a ser
ligeramente alcalino, y el contenido de nitrógeno mejoró. No
obstante, la capacidad de intercambio catiónico (CIC),
el contenido de
CaCO3, fósforo
y potasio
disminuyeron. En
cuanto al
contenido de
materia orgánica (M.O), al cuarto mes el T3
(75 ml/ L de
EM) experimentó unadisminución
de 3.82 %
en la
evaluación inicial
a 2.55%.
Tabla
2
Características
físicas
y
químicas
del
suelo,
según
fecha
y
tratamiento
Característica
|
Marzo
2022
|
Julio
(4
meses),
según
tratamiento
|
|
|
Testigo
|
T1
|
T2
|
T3
|
Físicas
|
|
|
|
|
|
A rena
(%)
rena
(%)
|
95
|
96
|
96
|
96
|
96
|
Limo
(%)
|
2
|
4
|
4
|
4
|
4
|
Arcilla
(%)
|
3
|
0
|
0
|
0
|
0
|
Clase
textural
|
A
|
A
|
A
|
A
|
A
|
Químicas
|
|
|
|
|
|
p H
(H20)
H
(H20)
|
6.33
|
7.01
|
7.33
|
7.3
7
|
7.42
|
CaCO3
(%)
|
1.62
|
0.89
|
0.89
|
0.8
9
|
0.89
|
M.O(%)
|
3.82
|
4.86
|
5.64
|
5.3
7
|
2.55
|
N
(%)
|
0.04
|
0.05
|
0.06
|
0.0
9
|
0.08
|
P
(ppm)
|
8.2
|
2.9
|
1.6
|
2.4
|
2.6
|
K
(ppm)
|
165
|
56
|
76
|
89
|
114
|
CE
(mS/cm)
|
0.12
|
0.64
|
0.61
|
0.5
|
0.61
|
Ca+2
(meq/100g)
|
4.59
|
5.79
|
5.7
|
4.4
|
4.59
|
Mg+2
(meq/100g)
|
1.22
|
0.54
|
0.61
|
0.5
6
|
0.67
|
K+
(meq/100g)
|
|
|
|
|
0.19
|
0.06
|
0.09
|
0.1
5
|
0.17
|
Na+
(meq/100g)
|
|
|
|
|
0.23
|
0.01
|
0.01
|
0.0
1
|
0.01
|
Suma
de
cationes
|
6.23
|
6.4
|
6.4
|
5.1
2
|
5.44
|
Suma
de
Bases
|
6.23
|
6.4
|
6.4
|
5.1
2
|
5.44
|
%
Saturación
de
Bases
|
93
|
100
|
100
|
100
|
100
|
Fuente:
Elaboración
Propia.
Nota.
M.O:
materia
orgánica;
CE:
conductividad
eléctrica.
Evaluación
del
desarrollo
vegetativo
del
cultivo
de
pitahaya
(Hylocereus
undatus)
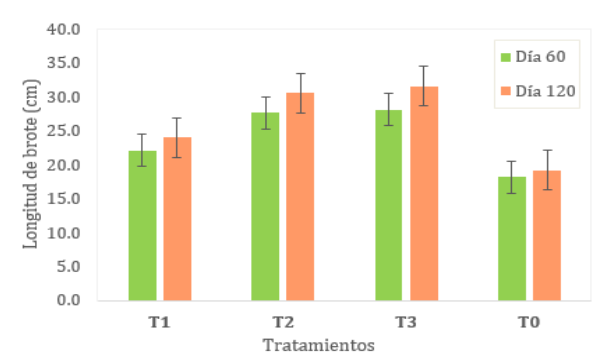
Longitud de
brote, se
muestran las
medias de
la variable
de longitud
de brote
(cm) en la
Tabla 3,
siendo el
coeficiente de
variación de
21.52% y
22.05% para
el día
60 y
120 de evaluación
respectivamente. Según
la prueba
Tukey al
5%, se
evidenció que
al día
60 de evaluación
existió diferencia
significativa del
T2 (50
ml/L de
EM) y
T3 (75
ml/L de
EM) con
respecto
al
T1
(25
ml/L
de
EM)
y
el
testigo
(T0),
cuya
longitud
inicial
del
esqueje
fue de
30
cm.
No
existió
diferencia
significativa
entre
el
testigo
(T0)
y
T1,
y
el
T2
y
T3.
Al
día 120
de
evaluación
se
evidenció
diferencia
significativa
de
todos
los
tratamientos
(T1,
T2, T3)
con respecto
al testigo.
No se
evidenció diferencia
significativa entre
el T2
y T3
(ver fig. 1).
Tabla
3
Longitud promedio
de brote
Tratamiento
|
Dosis
|
Longitud
promedio
de
brote
(cm)
|
|
|
Día
60
|
Día
120
|
T1
EM
|
25
ml/L
agua
|
22.08
a
|
24.00
|
T2
EM
|
50
ml/L
agua
|
27.67
b
|
30.50
a
|
T3
EM
|
75
ml/L
agua
|
28.08
b
|
31.58
a
|
T0
Testigo
absoluto
|
Sin
aplicación
|
18.17
a
|
19.17
|
Coeficiente
de
variación
(CV%)
|
|
21.52
|
22.05
|
Fuente:
Elaboración
Propia.
Nota.
Media con
letra común
indican que
no son
estadísticamente
significativas (p>
0.05).
Figura 1
Longitud
de
brote
promedio
de
pitahaya
Fuente:
Elaboración
Propia.
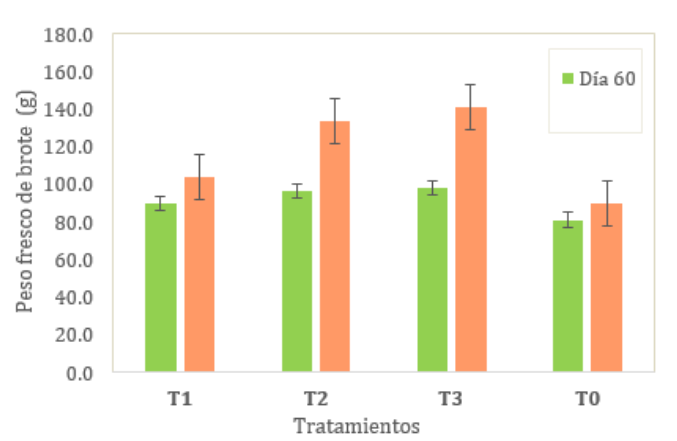
Peso
fresco
de
brote,
se
muestran
las medias de
la
variable
peso
fresco
de
brote
(g)
(ver Tabla
4), siendo
el coeficiente
de variación
de 14.15%
y 22.16%
para el
día 60
y 120
de evaluación
respectivamente. Según
la prueba
Tukey al
5%, se
evidenció que
al día
60 de evaluación
no
existió
diferencia
significativa
entre
todos
los
tratamientos
(T1,
T2,
T3)
y
el testigo.
No
se
evidenció
diferencia
significativa
en
el
T2
y
T3,
y
el
T1
y
TO.
Al
día
120
de evaluación
si
se
evidenció
diferencia
significativa
del
T2
y
T3
con
respecto
al
T0
(ver
fig. 2).
Tabla
4
Peso
fresco
promedio
de
brote
Tratamiento
|
Dosis
|
Peso
fresco
promedio
de
brote
(g)
|
|
|
Día
60
|
Día
120
|
T1
EM
|
25
ml/L
agua
|
90.07
a
|
104.03
a
|
T2
EM
|
50
ml/L
agua
|
96.54
a
|
133.65
b
|
T3
EM
|
75
ml/L
agua
|
98.30
a
|
140.83
b
|
T0
Testigo
absoluto
|
Sin
aplicación
|
81.17
a
|
90.25
a
|
Coeficiente
de
variación
(CV%)
|
|
14.15
|
22.16
|
Fuente:
Elaboración
Propia.
Nota.
Media con
letra común
indican que
no son
estadísticamente
significativas (p>
0.05).
Figura 2
Peso
fresco
promedio
de
brote
de
pitahaya
Fuente:
Elaboración
Propia.
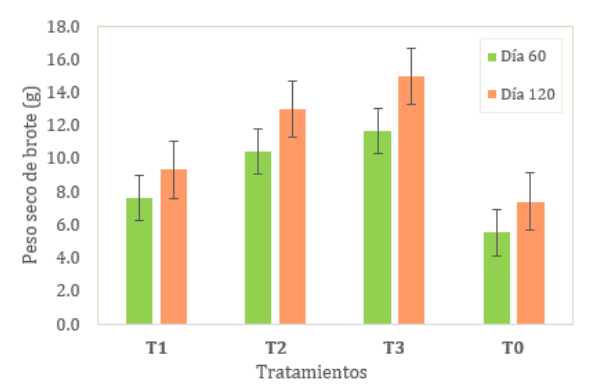
Peso seco
de brote,
se muestran
las medias
de la
variable peso
seco de
brote (g)
(ver Tabla 5),
siendo el
coeficiente de
variación de
30.07% y
30.88% para
el día
60 y
120 de evaluación
respectivamente.
Según la
prueba Tukey
al 5%,
se evidenció
que al
día 60
de evaluación
existió diferencia
significativa
en
el
T1,
T2
y
T3
con
respecto
al
testigo.
Al
día
120
de
evaluación no
se evidenció
diferencia significativa
entre el
T1 y
el testigo,
ni entre
el T2
y T3.
El T3 (dosis: 75
ml/L de EM) tuvo mejor media de peso seco y el testigo la menor media
en ambos días de evaluación (ver
fig. 3).
Tabla
5
Peso
seco
promedio
de
brote
Tratamiento
|
Dosis
|
Peso
seco
promedio
del
brote
(g)
|
|
|
Día
60
|
Día
120
|
T1
EM
|
25
ml/L
agua
|
7.64
|
9.35
a
|
T2
EM
|
50
ml/L
agua
|
10.46
a
|
13.01
b
|
T3
EM
|
75
ml/L
agua
|
11.68
a
|
14.98
b
|
T0
Testigo
absoluto
|
Sin
aplicación
|
5.55
|
7.41
a
|
Coeficiente
de
variación
(CV%)
|
|
30.07
|
30.88
|
Fuente:
Elaboración
propia
Nota:
Media
con
letra
común
indican
que
no
son
estadísticamente
significativas
(p> 0.05).
Figura 3
Peso
seco
promedio
de
brote
de
pitahaya.
Fuente:
Elaboración
propia
Evaluación
del
desarrollo
radicular
del
cultivo
de
pitahaya
(Hylocereus
undatus).
Longitud
de
raíz,
se
muestran
las
medias
de
la
variable
de
longitud
de
raíz
(cm)
(ver
Tabla 6), siendo
el coeficiente de variación de 14.14% y 14.34% para el día 60 y 120
de evaluación respectivamente.
Según la
prueba Tukey
al 5%,
se evidenció
que al
día 60
de evaluación
existió diferencia
significativa en el T1, T2, T3 con respecto al testigo. Sin embargo,
no se evidenció diferencia significativa entre el T2 y T3. Al día
120 de evaluación no se evidenció diferencia
significativa entre
el T1
y el
testigo, ni
entre los
tratamientos T1,
T2 y
T3. El T3 tuvo
mejor media de longitud de raíz y el testigo la menor media en ambos
días de evaluación (ver fig.4).
Tabla
6
Longitud
promedio
de
raíz
Tratamiento
|
Dosis
|
Longitud
promedio
de
raíz
(cm)
|
|
|
Día
60
|
Día
120
|
T1
EM
|
25
ml/L
agua
|
33.93
|
37.00
a
b
|
T2
EM
|
50
ml/L
agua
|
38.63
a
|
43.67
b
|
T3
EM
|
75
ml/L
agua
|
39.67
a
|
45.00
b
|
T0
Testigo
absoluto
|
Sin
aplicación
|
29.00
|
33.42
a
|
Coeficiente
de
variación
(CV%)
|
|
14.14
|
14.34
|
Fuente:
Elaboración
propia
Nota:
Media
con
letra
común
indican
que
no
son
estadísticamente
significativas (p>0.05).
Figura 4
Longitud
promedio
de
raíz
de
pitahaya
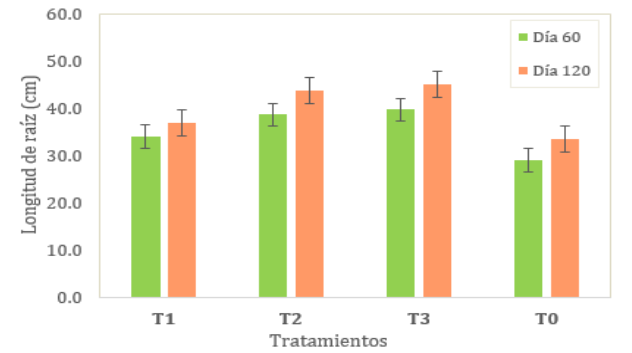
Fuente:
Elaboración
propia
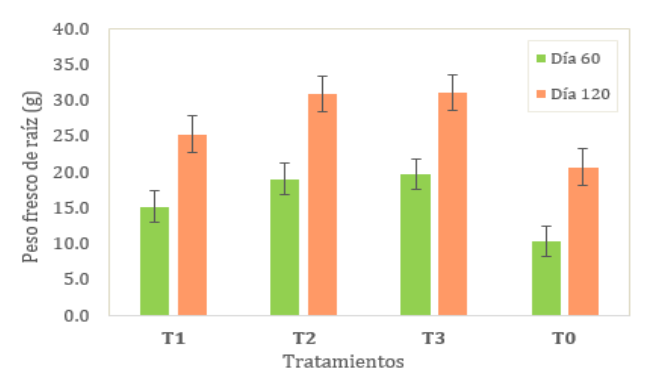
Peso
fresco
de
raíz,
se
muestran
las
medias
de
la
variable
de
peso
fresco
de
raíz
(g)
(ver Tabla
7), siendo
el coeficiente
de variación
de 27.05%
y 21.38%
para el
día 60
y 120
de evaluación respectivamente.
Según la
prueba Tukey
al 5%,
se evidenció
que al
día 60
de evaluación
existió diferencia significativa en el T1, T2, T3 con respecto al testigo. No
obstante, no se evidenció diferencia significativa entre el T2 y T3.
Al día 120 de evaluación no se evidenció
diferencia significativa
entre el
T1 y
T0, y
entre los
tratamientos T1,
T2 y
T3. El T3
tuvo mejor
media de
peso fresco
de raíz
y el
testigo la
menor media
en ambos
días de evaluación (ver fig. 5).
Tabla
7
Peso
fresco
promedio
de
raíz
Tratamiento
|
Dosis
|
Peso
fresco
promedio
de
raíz
(g)
|
|
|
Día
60
|
Día
120
|
T1
EM
|
25
ml/L
agua
|
15.15
|
25.24
a
b
|
T2
EM
|
50
ml/L
agua
|
18.99
a
|
30.90
b
|
T3
EM
|
75
ml/L
agua
|
19.62
a
|
31.10
b
|
T0
Testigo
absoluto
|
Sin
aplicación
|
10.30
|
20.64
a
|
Coeficiente
de
variación
(CV%)
|
|
27.05
|
21.38
|
Fuente:
Elaboración
propia
Nota:
Media
con
letra
común
indican
que
no
son
estadísticamente
significativas (p>0.05).
Figura 5
Peso
fresco
promedio
de
raíz
de
pitahaya
Fuente:
Elaboración
propia
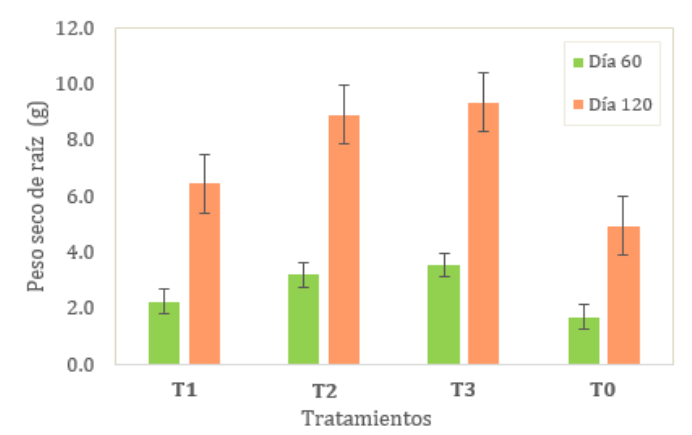
Peso seco
de raíz,
se muestran
las medias
de la
variable de
peso seco
de raíz
(g) (ver tabla
8), siendo
el coeficiente de
variación de 37.09%
y 31.36% para
el día 60
y 120 de
evaluación respectivamente.
Según la
prueba Tukey
al 5%,
se evidenció
que al
día 60
de evaluación
existió diferencia significativa en el T2, T3 con respecto al testigo. Sin
embargo, no hubo diferencia
significativa entre
el
T2
y
T3;
T1 y T2;
y T1 y el
testigo.
Al
día 120 de
evaluación no
existió diferencia
significativa entre
el T1
y el
testigo, ni
entre el
T2 y
T3. El
T3 tuvo mejor
media de
longitud de
raíz y
el testigo
la menor
media en
ambos días
de evaluación
(ver fig. 6).
Tabla
8
Peso
seco
promedio
de
raíz
Tratamiento
|
Dosis
|
Peso
seco
promedio
de
raíz
(g)
|
|
|
Día
60
|
Día
120
|
T1
EM
|
25
ml/L
agua
|
2.25
a
c
|
6.44
a
|
T2
EM
|
50
ml/L
agua
|
3.19
b
c
|
8.90
b
|
T3
EM
|
75
ml/L
agua
|
3.54
b
|
9.34
b
|
T0
Testigo
absoluto
|
Sin
aplicación
|
1.69
a
|
4.94
a
|
Coeficiente
de
variación
(CV%)
|
|
37.09
|
31.36
|
Fuente:
Elaboración
propia
Nota:
Media
con
letra
común
indican
que
no
son
estadísticamente
significativas
(p> 0.05).
Figura 6
Peso
seco
promedio
de
raíz
de
pitahaya
Fuente:
Elaboración propia
Discusiones
En cuanto
a su
investigación, con
respecto al
N en
el suelo,
se presentó
un aumento
en los tratamientos. Siendo el tratamiento con mayor contenido
de N el T2 (dosis: 50 ml/L de
EM) con 0.09%,
seguido del
T3 (dosis:
75 ml/L
de EM)
con 0.08% y el
T1 (dosis:
25 ml/L de EM) con 0.06%. Así mismo, mencionan que este
comportamiento es debido a que se añadieron microrganismos
eficientes, compuesta por una gran diversidad microbiana con
capacidad de fijar, solubilizar y liberar elementos como el
nitrógeno, potasio, fósforo,
azufre, calcio
y magnesio
(Monge et
al., 2022).
Por otro
lado, en
cuanto al contenido de K, al cuarto mes (julio) se observó
una disminución en todos los tratamientos, lo cual es debido a que
tanto en los tratamientos como en el testigo no se aplicaron
enmiendas que
incrementen el
contenido de
K en
el suelo.
La disponibilidad
del fósforo
(P)
es
importante
para
el
desarrollo
y
crecimiento
vegetativo
puesto
que
forma
parte de más del
0.2% del
peso seco
de la
planta (Banerjee
et al.,
2010).
En esta investigación el contenido de P en el mes de julio presentó
una disminución drástica en los tratamientos con la aplicación de
EM a 25 ml/L (1.6 ppm), 50 ml/L (2.4 ppm),
75 ml/L
(2.6 ppm)
en comparación
con la
evaluación inicial
(marzo), en el
cual se obtuvo 8.2
ppm de P. Esto es debido a que durante el experimento no se añadieron
enmiendas, por lo que la planta absorbió el fósforo soluble
disponible. Además, que los EM añadidos contienen microorganismos
solubilizadores de fosfato que mediante diferentes mecanismos
biológicos solubilizaron los fosfatos insolubles. Ruiz (2021)
menciona que
los microorganismos
eficientes tienen
la capacidad
de producir
proteasas y
fosfatasas,
siendo
ambas
enzimas
esenciales
en
el
proceso
de
solubilización
y
mineralización del
fósforo orgánico, mejorando la disponibilidad de los nutrientes
necesarios para el mantener adecuada la relación suelo - planta.
Por
su
parte,
Satyaprakash
et
al.
(2017)
señalan
que
los
microorganismos
eficientes
que solubilizan
fosfato
en
el
suelo
tienen
diversos
mecanismos.
Producen
ácidos orgánicos
que facilitan la
solubilización de los fosfatos insolubles (fosfatos secundarios y
terciarios) principalmente en
el área
del sistema
radicular.
Posteriormente, los
fosfatos solubles
son absorbidos por
la planta,
favoreciendo así
su desarrollo
vegetativo.
Respecto al contenido
de materia
orgánica en la
primera evaluación,
solo en el T3
se evidenció una reducción de 3.82% a 2.55% al cuarto mes de
evaluación, a una dosis de aplicación de 75 ml/L de EM. Este
comportamiento se debe a la presencia de microrganismos
eficientes que
aceleran la
metabolización de
la materia
orgánica y
genera que los
macro y
micronutrientes se
encuentren más
disponibles para
la planta
(Medina et al.,
2014), teniendo
efectos positivos
en la
tasa de
germinación de
semillas, así
como en
el desarrollo y crecimiento de brotes vegetativos y
reproductivos (Ruiz, 2021). Los EM al entrar
en contacto
con la
materia orgánica
sintetizan y
liberan ácidos
orgánicos, minerales
quelatados y sustancias
antioxidantes, facilitando la
descomposición de la
materia orgánica, aumentando el contenido de humus, y
modificando la micro y macro flora de los suelos, convirtiéndose así
en supresores de enfermedades para los cultivos (Morocho & Leiva,
2019).
Conclusiones
La disponibilidad de nutrientes:
fósforo, nitrógeno
y potasio, es
media. Mientras que
al cuarto mes se evidenció algunos cambios, el pH pasó a ser
ligeramente alcalino, y el contenido
de nitrógeno
mejoró. No
obstante, la
capacidad de
intercambio catiónico
(CIC), el contenido de CaCO3, fósforo y potasio disminuyeron.
En cuanto al contenido de materia orgánica (M.O), al cuarto mes el
T3 (75 ml/ L de EM) experimentó una disminución de 3.82 % en la
evaluación inicial a 2.55%.
La dosis de EM que permitió obtener las mayores medias en los
parámetros de desarrollo vegetativo (longitud de brote, peso fresco
y peso seco de brote) y desarrollo radicular
(longitud de
raíz, peso
fresco y
peso seco
de raíz)
en el
cultivo de
pitahaya fue
la aplicación de 75 ml/L de EM.
La aplicación de EM para el enraizamiento y desarrollo vegetativo
del cultivo de pitahaya
fue
favorable
en
todos
los
tratamientos.
A
pesar
que
se
evidenció
una
tendencia
al incremento de
los valores de los parámetros a medida que la dosis fue mayor, no se
encontraron diferencias
significativas entre
el T2
(50 ml/L
de EM)
y T3
(75 ml/L
de EM). En
este sentido,
para hacer
el uso
eficiente de
los EM
en los
cultivos de
pitahaya, y
obtener efectos positivos
en el
desarrollo de
la planta
es suficiente
con la
aplicación de
dosis de
50 ml/L de EM (T2).
Referencias
Alarcon, J., Recharte, D., Yanqui, F., Moreno, S., & Buendía, M.
(2020). Fertilizar con microorganismos eficientes autóctonos tiene
efecto positivo en la fenología, biomasa
y producción
de tomate
(Lycopersicum
esculentum Mill).
Scientia
Agropecuaria, 11(1), 67- 73.
https://doi.org/10.17268/sci.agropecu.2020.01.08
Banerjee,
S., Palit, R., Sengupta, C., & Standing, D. (2010). Stress
induced phosphate solubilization
by
Arthrobacter
sp.
and
Bacillus
sp.
isolated
from
tomato
rhizosphere.
Australian
Journal of crop science,
4(6),
378-383.
Calero, A.,
Pérez, Y.,
Quintero, E.,
Olivera, D.,
& Peña,
K. (2019).
Efecto de
la aplicación
asociada entre Rhizobium leguminosarum y microorganismos
eficientes sobre la producción
del fríjol
común. Ciencia
y
Tecnología
Agropecuaria,
20(2), 295-308.
https://doi.org/10.21930/rcta.vol20_num2_art:1460
Costa, D., Pio, R., Scarpare, J., Neubern, M., Paes, L., Dias, T., &
Bakker, S. (2006). Propagation
of red
pitaya
(Hylocereus
undatus)
by cuttings.
Ciencia e
Agrotecnología,
30(6), 1106-1109.
https://doi.org/10.1590/s1413-70542006000600009
Cuellar, L.,
Morales, E.,
& Trevino,
J. (2006).
La germinación
in vitro
una alternativa
para obtener explantes
en Cactáceas.
Zonas
Áridas, 10,
129-133.
http://www.lamolina.edu.pe/CIZA/PDFs/ZA10%20%20FINALweb.pdf#page=1
29
Enciso,
T.,
Zazueta,
M.,
Rangel,
M.,
Torres,
J.,
Romero,
M.,
&
Verdugo,
S.
(2011).
Calidad
postcosecha
de
frutos
de
pitahaya
(Hylocereus
undatus
Haw.)
cosechados
en
tres estados
de
madurez.
Revista
Fitotecnia
Mexicana,
34(1),
63-72.
Garbanzo,
G., Vega,
E., Rodríguez, J.,
Urbina, C., Lázaro, W., Alvarado, K., Barrientos, R., Duarte,
K., Mora, J., Trujillo, V., & Rojas, J. (2021). Evaluación de
tamaño de cladodios y bio-estimulantes de enraizamiento para la
propagación de pitahaya. Agronomía Costarricense, 45(2), 29-40.
https://doi.org/10.15517/RAC.V45I2.47765
Hoyos, D.,
Alvis, N.,
Jabib, L.,
Garcés, M.,
Pérez, D.,
& Mattar,
S. (2008).
Utilidad de
los microorganismos eficaces (em®) en una explotación
avícola de córdoba: Parámetros
productivos y
control ambiental.
Revista MVZ
Córdoba,
13(2), 1369-
1379. https://doi.org/10.21897/rmvz.397
Kishore,
K. (2016). Phenological growth stages of dragon fruit (Hylocereus
undatus) according
to the extended BBCH-scale. Scientia
Horticulturae, 213,
294-302. https://doi.org/10.1016/j.scienta.2016.10.047
Monge, J., Loría, M., y
Oreamuno, P. (2022).
Efecto de un biol en las
características del suelo y la producción de brotes en
pitahaya (Hylocereus sp.). UNED Research Journal,
14(1), e3836-e3836. https://doi.org/10.22458/URJ.V14I1.3836
Montesinos, J., Rodríguez, L., Ortíz, R., Fonseca, M., Ruíz, G., y
Guevara, F. (2015). Pitahaya (Hylocereus spp.) un recurso
fitogenético con historia y futuro para el trópico seco
mexicano. Cultivos Tropicales,
36, 67-76.
http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0258-
59362015000500007
Morocho, M.,
& Leiva,
M. (2019).
Microorganismos
efcientes, propiedades
funcionales y
aplicaciones
agrícolas.
Centro
agrícola,
46(2),
93-103.
Ruiz,
J.
(2021).
Comparación
productiva
del
cultivo
de
pitahaya
(Hylocereus
undatus)
a
la
aplicación
de microorganismos de montaña y microoganismos eficientes en el
recinto de Cerecita
- Guayas
[Tesis de
licenciatura, Universidad Agraria del Ecuador]. Repositorio
institucional de la Universidad Agraria del Ecuador.
https://cia.uagraria.edu.ec/Archivos/RUIZ
LOYOLA JOSSELYN.pdf
Satyaprakash,
M., Nikitha, T., Reddi, E. U. B., Sadhana, B., & Satya, S.
(2017). Phosphorous and phosphate solubilising bacteria and their
role in
plant
nutrition.
International
Journal
of
Current
Microbiology
and
Applied
Sciences,
6(4),
2133-2144.
https://doi.org/10.20546/ijcmas.2017.604.251
Vargas,
K.
y
López,
R.
(2020).
Guía
Técnica
del
cultivo
de
pitahaya
(Hylocereus
megalanthus)
en la
región
Amazonas.
http://repositorio.inia.gob.pe/handle/inia/1052
Vargas,
Y.,
Pico,
J.,
Díaz,
A.,
Sotomayor,
D.,
Burbano,
A.,
Caicedo,
C.,
Paredes,
N.,
Congo, C.,
Tinoco,
L.,
Bastidas,
S.,
Chuquimarca,
J.,
Macas,
J.,
&
Viera,
W.
(2020).
Manual del
Cultivo de Pitahaya para la Amazonía Ecuatoriana. Instituto
Nacional de Investigaciones Agropecuarias (INIAP).
https://repositorio.iniap.gob.ec/handle/41000/5551
Verona, A., Urcia, J., y Paucar, L. M. (2020). Pitahaya (Hylocereus
spp.): Cultivo, características fisicoquímicas, composición
nutricional y compuestos bioactivos.
Scientia Agropecuaria, 11(3), 439-453.
https://doi.org/10.17268/SCI.AGROPECU.2020.03.16
Warusavitharana, A.,
Peiris, K.,
Wickramatilake, K.,
Ekanayake, A.,
Hettiarachchi, H.,
& Bamunuarachchi,
J.
(2017).
Performance
of
dragon
fruit
(Hylocerus
undatus)
in
the low
country
wet
zone
(LCWZ)
of
Sri
Lanka.
ISHS
Acta
Horticulturae,
1178,
31-34.
https://doi.org/10.17660/ACTAHORTIC.2017.1178.5
Zafar, M.,
Abbasi, M.
K., Khan,
M. A.,
Khaliq, A.,
Sultan, T.,
& Aslam,
M. (2012).
Effect of Plant Growth-Promoting Rhizobacteria on Growth,
Nodulation and Nutrient Accumulation
of
Lentil
Under
Controlled
Conditions.
Pedosphere,
22(6),
848-859.
https://doi.org/10.1016/S1002-0160(12)60071-X






